为了降低和控制风险,同时兼顾效率,飞利浦采用三级评审机制:
-
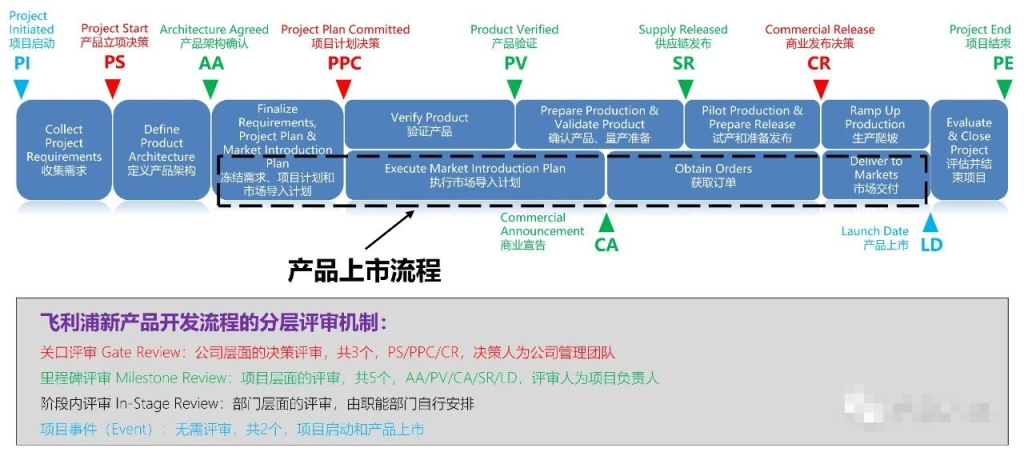
关口评审:这是公司层面的评审,决策人为公司管理团队。评审结果将决定产品是进入下一阶段,还是进行返工、暂停或者终止。
-
里程碑评审:这是项目层面的评审,决策人为项目团队。评审结果将决定产品是否进入下一里程碑。
-
阶段内评审:这是部门层面的评审,由职能部门自行管理。部门层面的评审,通常都是专业评审,可以为里程碑评审和关口评审提供意见。
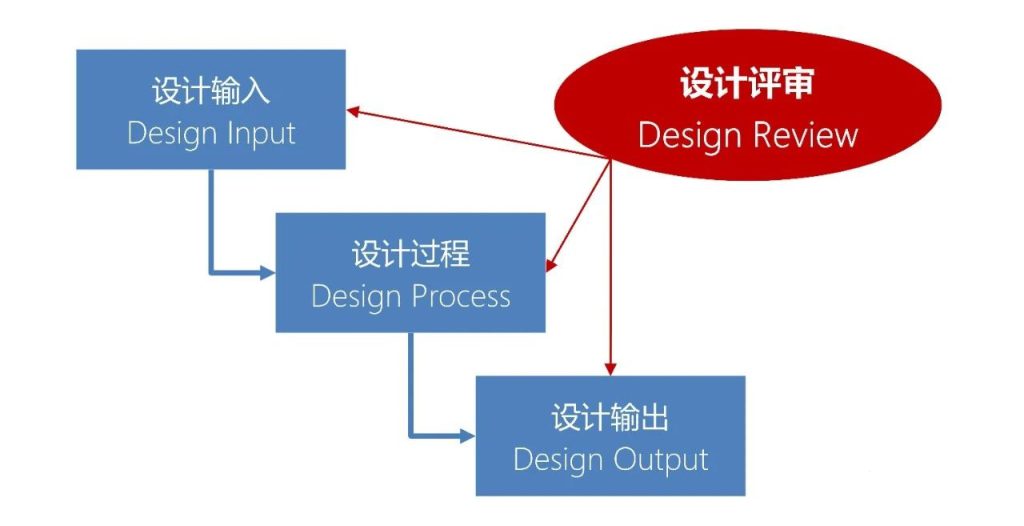
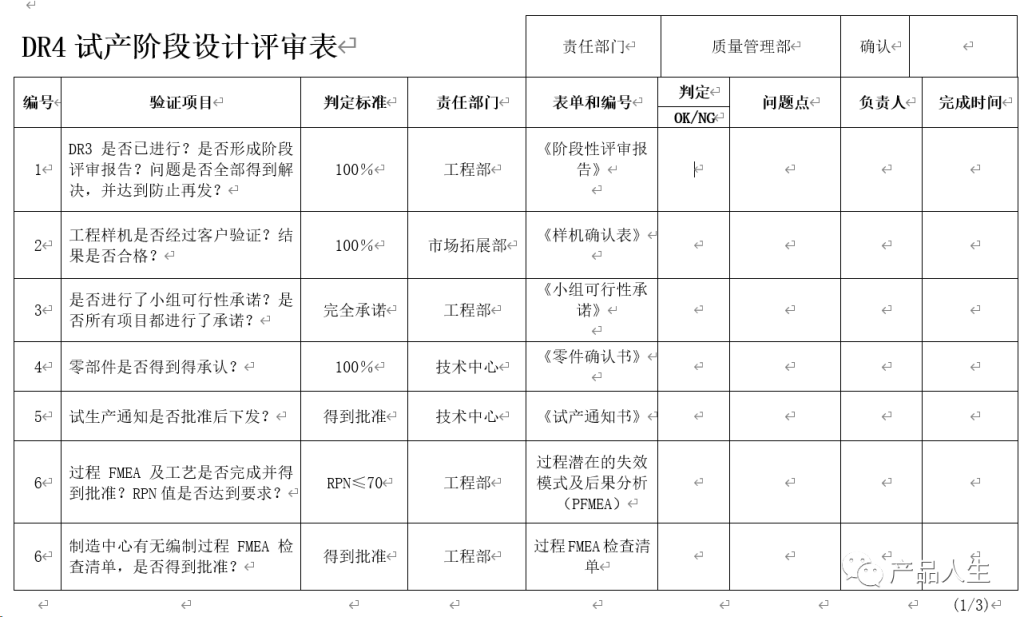
设计评审,在飞利浦是一种阶段内评审,由职能部门自行组织和管理。
这种灵活的评审机制,一方面确保及时检查和发现设计问题;另一方面,可以发挥工程师的积极性,提高评审效率。
设计评审在医疗器械开发过程中扮演者关键的角色,有助于确保产品的安全、合规、高能性,同时提高产品的竞争力和用户满意度。2023年医疗器械注册和监管会也明确了重点的工作方向,法规建设、医疗器械创新审批、上市前和上市后监管依旧是国内法规的重点。 在国际医疗器械展览会 2023 Quality Expo 现场曾有许多展商带来了质量检测仪,包括新型径向支撑力测试仪、高性能电磁动态疲劳测试机、黑带Pro气密测试仪、T90四通道测漏仪、相转变温度测试仪、机械测试仪等。如果贵司专注于医疗器械质量管理,尽在国际医疗器械展览会Medtec China,点击立即报名参展。
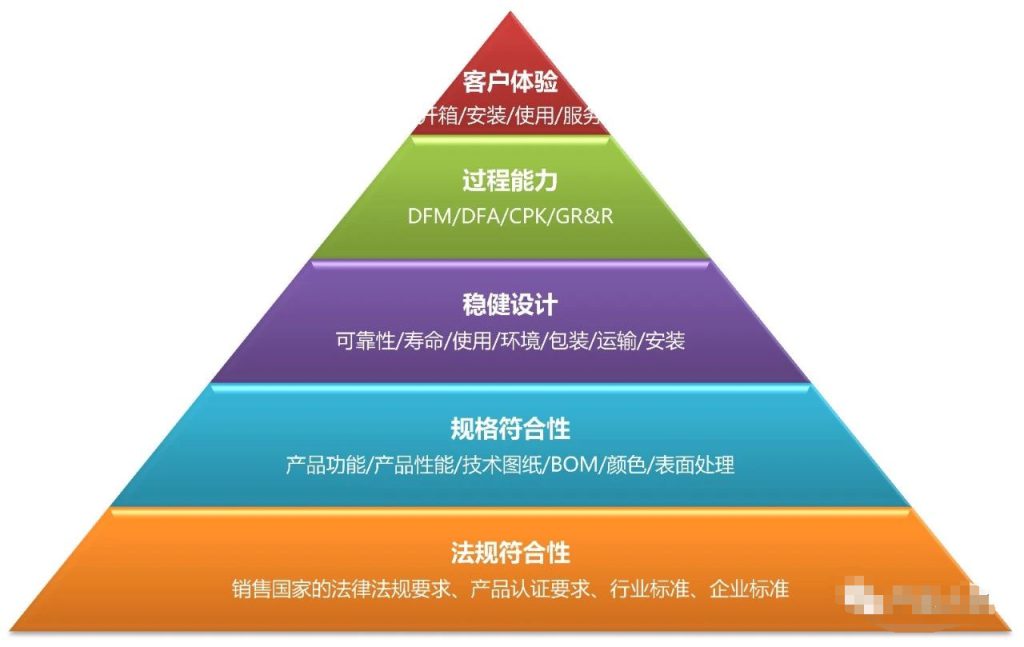
1)法规符合性
主要包括:法律法规的符合性,认证的符合性,行业标准和企业标准的符合性等等。
2)规格符合性
产品设计,必须符合前期的产品定义,以及根据产品定义转化而来的产品规格,确保产品的可用性。
主要包括:产品的功能要求、性能要求、颜色要求、表面处理要求等等。
3)稳健设计
产品设计,必须符合可靠性和寿命的要求,确保产品的耐用性和好用性。
主要包括:产品的可靠性、产品寿命、使用环境、运输条件、安装条件等要求。
4)过程能力
过程能力,这是产品持续满足客户需求的能力,确保产品能够批量生产。
5)客户体验
产品设计,必须为客户提供良好的产品体验,确保客户满意。
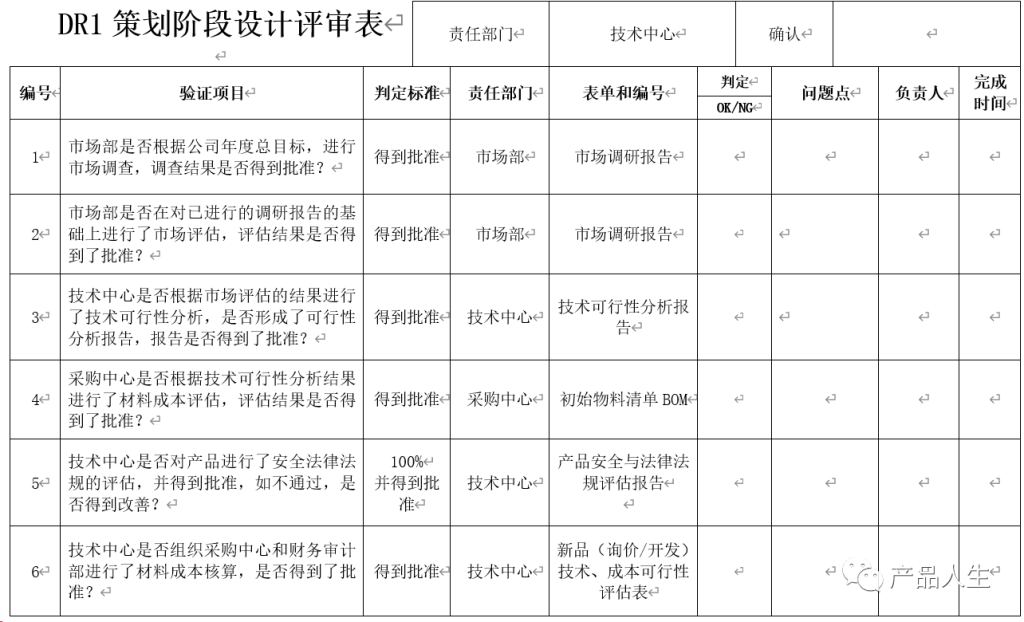
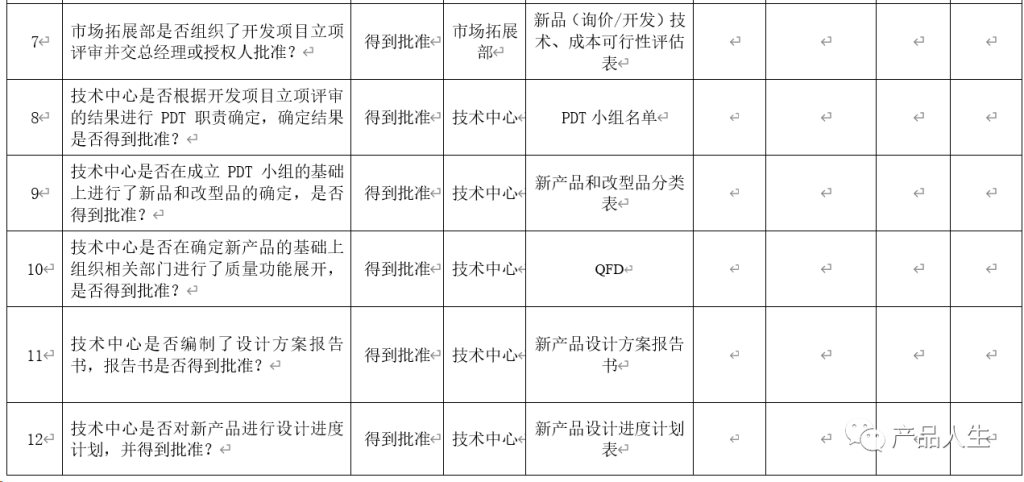
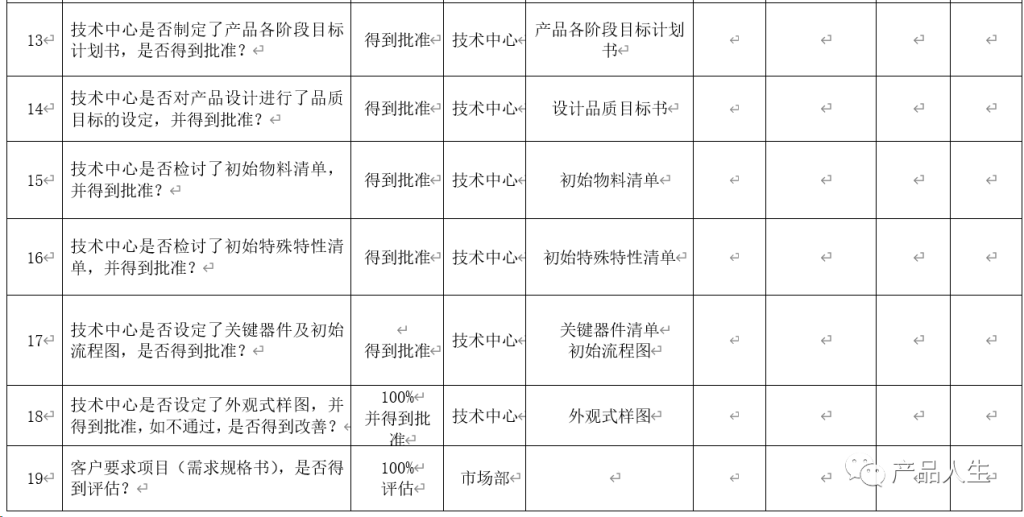
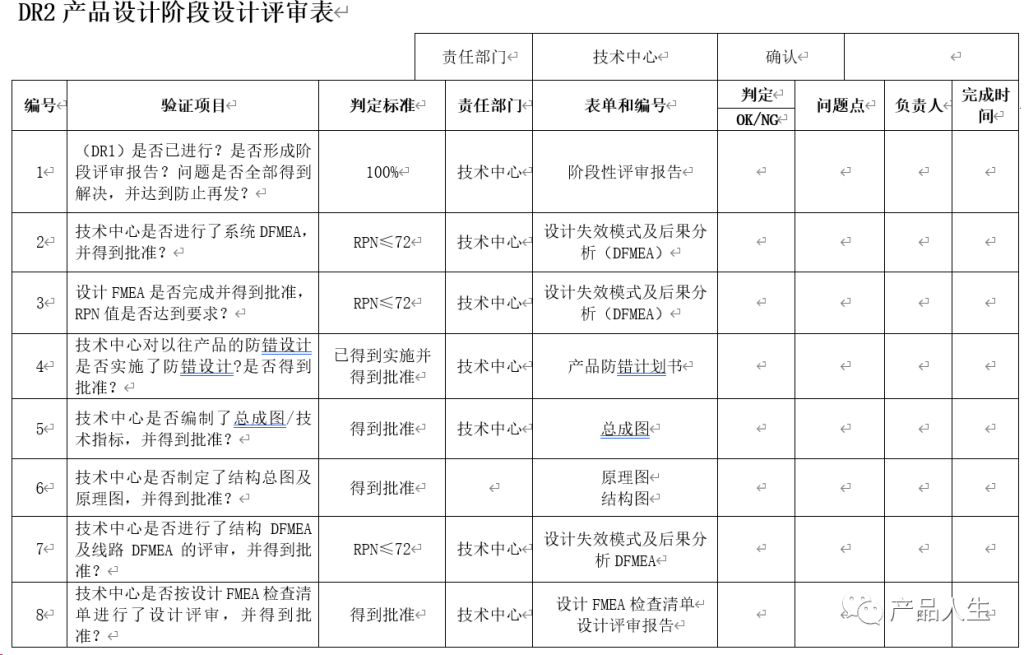
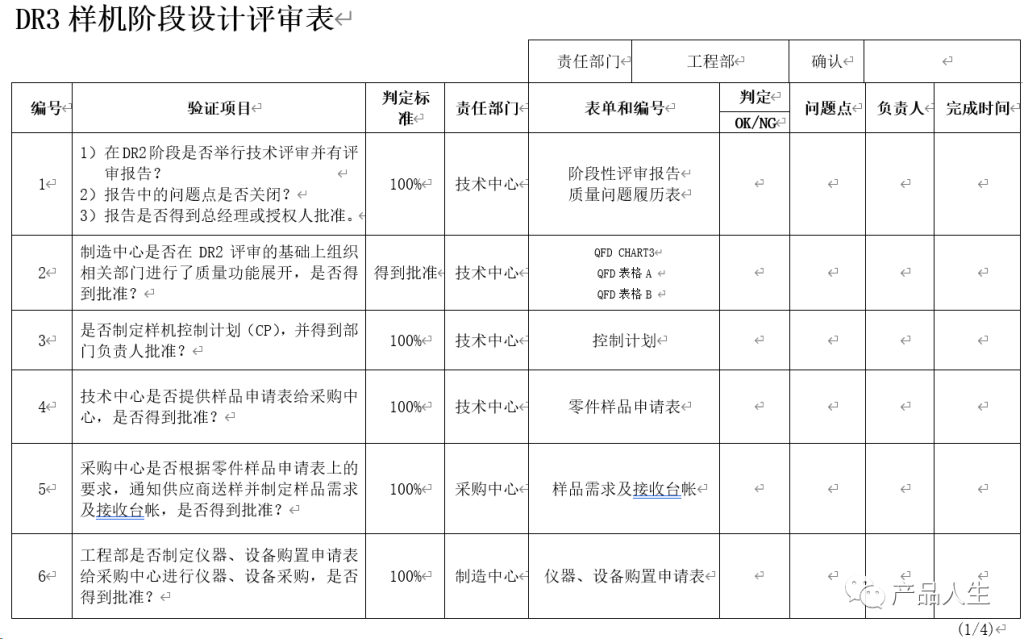
一份详细的设计评审清单,无疑可以提高评审的速度和质量,同时大大减小出现评审遗漏和失误的机率。
本文,将为您提供四份设计评审要素表(checklist):