导语:本文为学习性总结,主要源于审评五部赵艳红老师《含银盐敷料产品的技术审评关注点》培训,同时参考ISO/TR10993-22《医疗器械生物学评价第22部分纳米材料指南》、《含银敷料注册技术审查指导原则》(征求意见稿)》及国家食品药品监督管理总局关于规范含银盐医疗器械注册管理有关事宜的公告(2015年第225号),主要从含银敷料的监管要求、含银敷料技术评审关注点介绍,以为诸君提供点滴参考。
第一部分 含银敷料监管情况
2014年,原国家食品药品监督管理总局(CFDA)暂停了对含银盐敷料的审批工作。经过深入的讨论和审慎的研究,最终在2015年CFDA发布了2015年第225号公告,决定将含银盐的医疗器械产品,包括但不限于敷料、导尿管等,统一纳入三类医疗器械管理范畴。这一决定与之前许多产品以第二类医疗器械身份上市的情况有所不同。
对于含有硝酸银、磺胺嘧啶银等银盐的产品,若产品主要通过银盐的抗菌作用实现其预期用途,如含有银盐的溶液、凝胶等,不作为医疗器械管理;若产品所含的银盐仅为复合在医疗器械上增加抗菌功能,抗菌为辅助作用,如含银盐涂层的导尿管、含银盐敷料等,按照第三类医疗器械管理。
Medtec认为值得注意的是这里是指的含银盐敷料,之所以使用这个词语,是为了明确区分含银盐产品和含银纳米颗粒的产品。也就是说现在的分类目录标准里的是不包含含纳米银颗粒的产品。
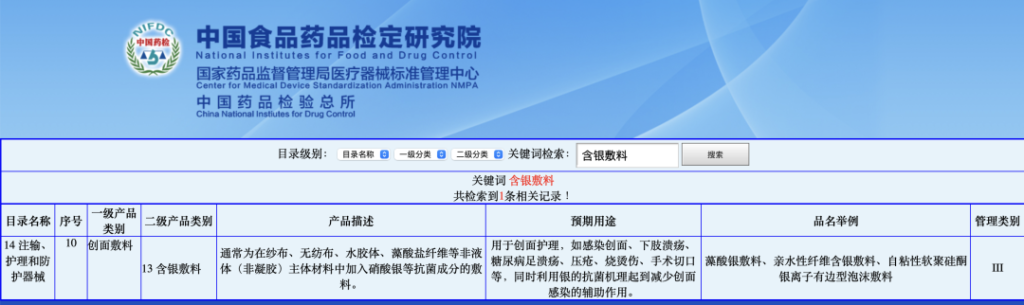
2018年发布的最新医疗器械分类目录中,含银敷料被归类于14-10-13项下,这一分类下的产品明确排除了含有纳米材料的产品。这些产品通常被视为以医疗器械功能为主的药械组合产品,尽管历年的文件中并未明确提及这一点,但这一理解隐含在药械组合产品注册相关的通告中,例如2009年的16号通告,尽管该通告现已废止。
带药物涂层的支架、带抗菌涂层的导管、含药避孕套、含药节育环等产品 ,按医疗器械进行注册管理,含抗菌、消炎药品的创口贴、中药外用贴敷类产品等。 按药品进行注册管理。
关于药械组合产品注册有关事宜的通告(2009年第16号已废止)
Medtec发现实际上这一规定与之前2015年公布的含银盐的医疗敷料作为第三类医疗器械管理的原则是一致的。2015年的医疗器械分类规则(微信公众号内回复 分类规则 即可获得)中第六条的规定,当医用敷料有以下情形,按照第三类医疗器械管理,包括:预期具有防组织或器官粘连功能,作为人工皮肤,接触真皮深层或其以下组织受损的创面,用于慢性创面,或者可被人体全部或部分吸收的。由于含银产品的银离子最终以开放性伤口的形式被人体吸收,故按照第三类医疗器械管理,所以也和分类规则中的原则是一致的。
第二部分 伤口愈合情况简介
主要是介绍产品的实际使用,帮助我们理解关于含银敷料的生物学评价的一些要求。
敷料的功能应该具有一系列特点(具体如下),最基本的功能是屏障与保护。皮肤受伤后,敷料需要保持一定的温度和湿度,若伤口有液体渗出,产品应具有一定的液体吸收性和组菌性,容易去除,有助于减轻疼痛。推出这类产品的原因是长期应用能释放活性物质的产品,这也是基于伤口的特点。
-
体温调节功能:使伤口保持恒定的温度(37°C);
-
水蒸气透过性:敷料与伤口接触面需保持一定湿度;有类似于皮肤的水分蒸发率;
-
液体吸收性:能吸收多余渗出物,有利于引流
-
阻菌性:防止微生物、有害微粒及其他有害物质污染伤口,起到屏障作用;
-
容易去除、减轻疼痛:移去敷料时不会损伤伤口,容易揭除,不伤肉芽组织,给患者带来较轻的疼痛;
-
持粘性、剥离强度:良好的粘附性,有些敷料自身不具有粘附性,需要第二层敷料覆盖。
-
YY/T0471.1-2004接触性创面敷料试验方法 第1部分:液体吸收性 -
YY/T0471.2-2004接触性创面敷料试验方法 第2部分:透气膜敷料水蒸气透过率 -
YY/T0471.3-2004接触性创面敷料试验方法第3部分:阻水性 -
YY/T0471.4-2004接触性创面敷料试验方法第4部分:舒适性 -
YY/T0471.5-2017接触性创面敷料试验方法第5部分:阻菌性 -
YY/T0471.6-2004接触性创面款料试验方法第6部分:气味控制 -
YY/T0148-2006医用胶带通用要求
-
YY/T1293.1-2016接触性创面數料第1部分:凡士林纱布 -
YY/T1293.2-2016接触性创面敷料第2部分:聚氨酯泡沫敷料 -
YY/T1293.4-2016接触性创面敷料第4部分:水胶体敷料 -
YY/T1293.4-2017接触性创面敷料第5部分:藻酸盐敷料 -
YY/T1293.4-2020接触性创面款料第6部分:贻贝黏蛋白敷料 -
YY/T 1477.1-2016《接触性创面敷料性能评价用标准试验模型第1部分:评价抗菌活性的体外创面模型》
-
YY/T 1477.2-2016《接触性创面敷料性能评价用标准试验模型第2部分:评价促创面愈合性能的动物烫伤模型》
-
YY/T 1477.3-2016《接触性创面敷料性能评价用标准试验模型第3部分:评价液体控制性能的体外创面模型》
典型性样品选择问题:有时企业提交的资料中提到规格或型号在市场上销售最多,这是对典型性的误解。在产品结构组成、包装材料、灭菌方式和预期用途不同的情况下,需要考虑样本的产品是否能代表典型性。在选择典型性样品时,若申报型号较多,需提交立卷声明。许多企业仅仅说明规格型号能代表产品的安全性、有效性,不说明原因。审评员无法判断典型性,因此必须从各个角度阐述为何是典型性样品。
送检产品应具备典型性,但这并不意味着仅凭一个典型性说明就能说明问题。具体情况进行产品分析,例如,尺寸大小的差异可能是合适的。但是,型号具有很多特殊性,不能随意选择 ABC型号,或者无依据的选择。在选择 aA型号后,需要提交典型性分析。通常我们是按照每一个性能指标分析,送检样品在每个性能中是否具有典型性,一般典型选择工艺实现最难或性能指标最差水平的型号进行。
无论是注册检测还是委托检测,全性能检测都是必须的,不能拼凑。例如,如果申报产品有 ABC 三个型号,选择 A型号作为典型性型号,就需要提交针对 A型号的全新检测报告。如果此时有两项A型号适用,但未检测,而选择了 B型号,那就相当于拼凑。需要注意的是,如果产品需要补检,应委托具有资质的医疗器械检验机构进行。
在亚慢性毒性试验中,样品的剂量选择、接触途径和接触时间需要综合考虑。应当首先考虑临床上的最大使用剂量和接触途径,然后评估时间是否能充分说明产品的亚慢性毒性。有些直接按照动物体重选择剂量,但这种方法忽略了人与动物在剂量换算上的差异。由于人体内个体差异较大,而动物相对均一,因此在大多数情况下,需要对动物剂量进行放大处理。放大的原则,CMDE回复如下:
对于试验中出现统计学差异的评价指标,试验报告需明确相关差异是否有生物学意义并提供理由、分析判断相关差异与受试产品的关系,而非仅简单列出具有统计学差异的项目。另外,对于通过植入方式接触受试品的亚慢性毒性试验,需提供植入剂量的确定依据,如,在动物可耐受情况下,推荐样本植入剂量为拟用人体临床剂量的50~100倍。
https://www.cmde.org.cn/splt/ltgxwt/20180913154300403.html
动物实验在生物学评价时具有一定的细胞毒性,需进一步评判伤口愈合的影响。目前动物实验模型存在局限性,主要集中在皮肤缺损、烫伤等部位,慢性伤口较少。在伤口愈合模型中,选择的动物种属,无论是是大鼠还是兔子,伤口愈合机制与人类差别很大。建议选择猪作为代表性模型。
8.生产制造信息
9.临床评价
10.说明书与样稿
-
对任何形式的银过敏者,禁用。
-
对肝、肾功能不良的患者,建议慎用。
-
对孕妇、哺乳期妇女、新生儿及幼儿,建议慎用。
-
对坏死组织导致的创面感染,禁止单一使用含银盐敷料作为创面感染的防治措施
-
如果同时使用油性药膏过量,此敷料的作用会被减弱。当进行电生理检查,如心电图(ECG)、脑电图(EEG)时,注意避免将此敷料接触电极或导电凝胶。
-
当患者进行核磁共振成像(MIRI)检查时,必须先将此敷料去除。
-
含银盐敷料仅为防治创面感染的辅助措施,不能替代创面清洁、清创和全身抗生素的使用。在创面坏死组织未经彻底清创前,建议临床医生慎用:对严重感染创面,创面坏死组织较多,创面脓毒症患者,有可能加重感染,建议临床医生慎用;出现系统性临床感染的情况下,含银盐敷料不能取代全身系统性的治疗或其他适当的抗感染治疗。
-
| 类手术切口、无感染风险的浅度创面、痂皮完整干燥且无明显创周炎症反应的深度创面、小面积的新鲜肉芽创面,不宜常规使用含银盐敷料。
-
使用含银盐敷料后创面感染控制未达到预期者,应积极从病因学角度分析原因,或寻求新的治疗措施,谨防创面感染进一步加重。
-
含银盐敷料为短期使用产品,如长期(>30d)或大面积使用含银盐敷料应慎重,应密切关注是否存在银过敏、局部银沉积、肝肾功能变化等不良反应;必要时监测血清银或尿银水平并进行血液学相关检查,应以防严重毒性不良反应。
- 反复作用可产生耐药性,使用含银敷料需对创面定期行病原微生物调查,以客观评价抗菌效果。
文章来源: 器械研发那些事
