本期,国际医疗器械展览会带您了解PFA的争议与共识:从损伤机制、疗效到并发症管理。
PFA核心机制与临床优势
非热消融的生物学突破
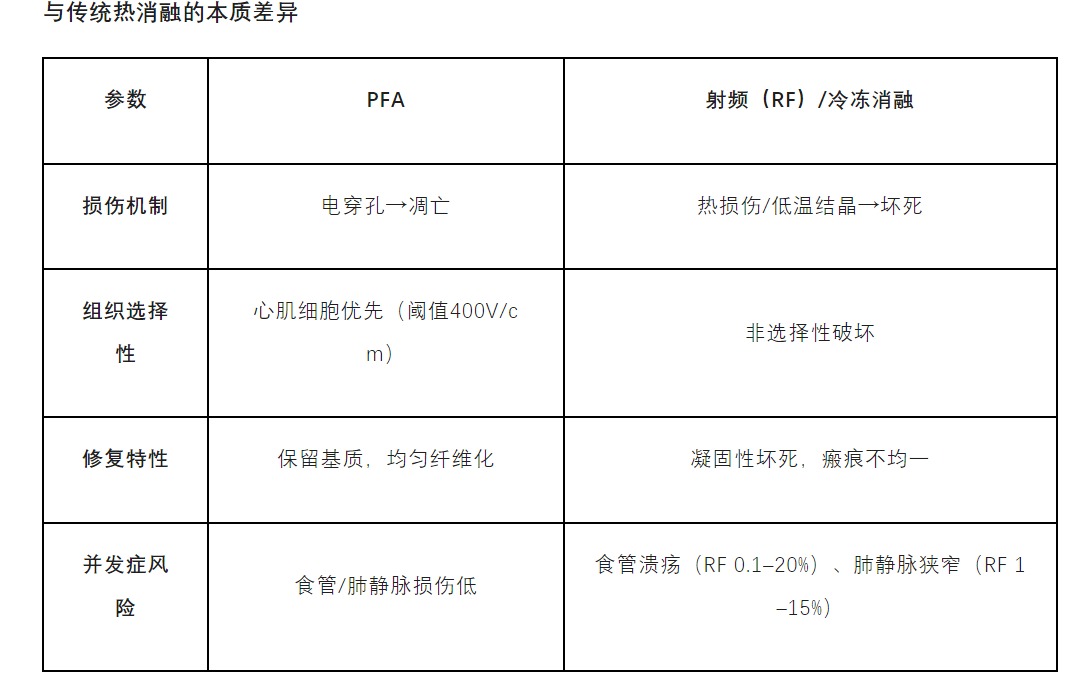
PFA通过高频短时电脉冲(1–10微秒,1500–2400V)在心肌细胞膜诱导纳米级电穿孔。从孔形成到凋亡的过程至今尚未完全阐明,可能与激活线粒体凋亡通路(细胞色素C→caspase 3/7)有关,诱导细胞凋亡,而非热损伤。
但认为PFA是完全非热消融的说法存在误导,在组织表面下测量时,PFA消融组织温度可升高5-10°C。尽管会产生少量温度升高,但未达凝固性坏死阈值(50℃),热量通过传导快速消散,保留细胞外基质,尤其适合食管、神经等易损结构保护。
技术参数与影响因素
-
脉冲参数:
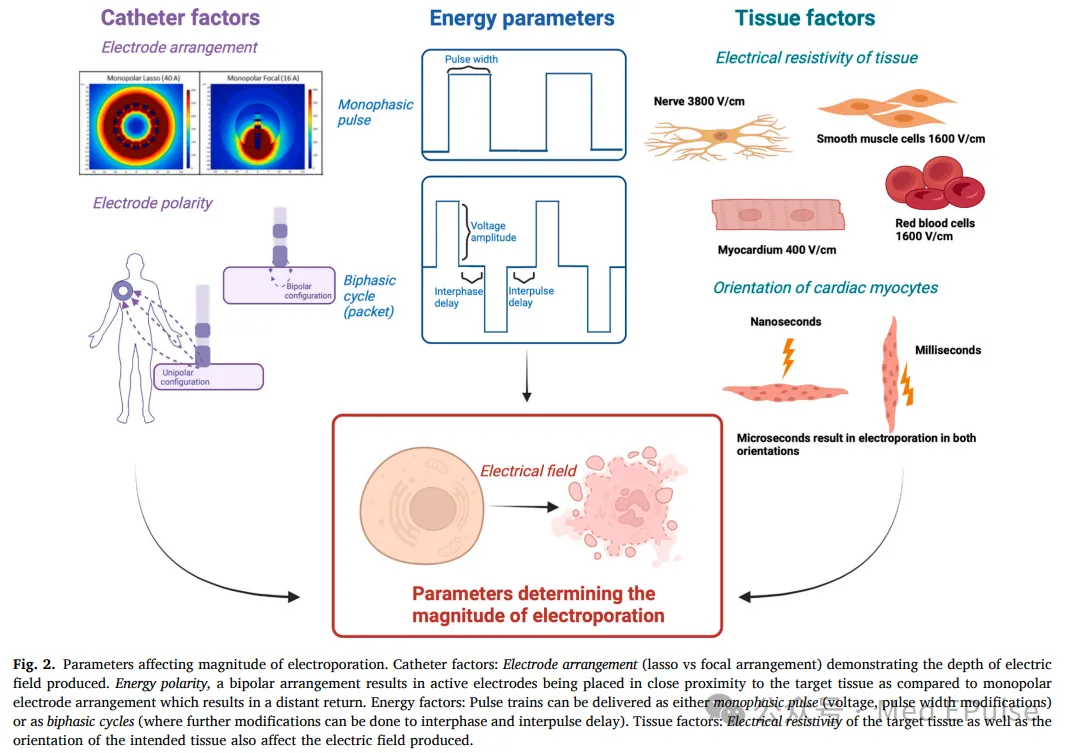
电压幅度、波形(单相/双相)、脉冲宽度(微秒级为主,纳秒级需更高电压以减少肌肉刺激和确保有效损伤)、脉冲间隔及数量影响能量传递与损伤深度。
双相波形减少肌肉收缩,但疗效弱于单相;大多数当前系统使用微秒级脉冲持续时间(1-10微秒范围内)。即使脉冲宽度从1微秒到2微秒的微小变化也会对组织深度产生显著影响。
-
导管设计:
单极配置损伤更深,双极配置适合大面积隔离;单极配置贴靠力>10–15g后损伤深度趋稳。
-
组织特性:心肌细胞电穿孔阈值(400V/cm)显著低于神经(3800V/cm)和平滑肌(1600V/cm),脂肪组织可衰减电场。
图片来源:Med EPluse
临床有效性:从肺静脉隔离到长期管理
急性隔离率
-
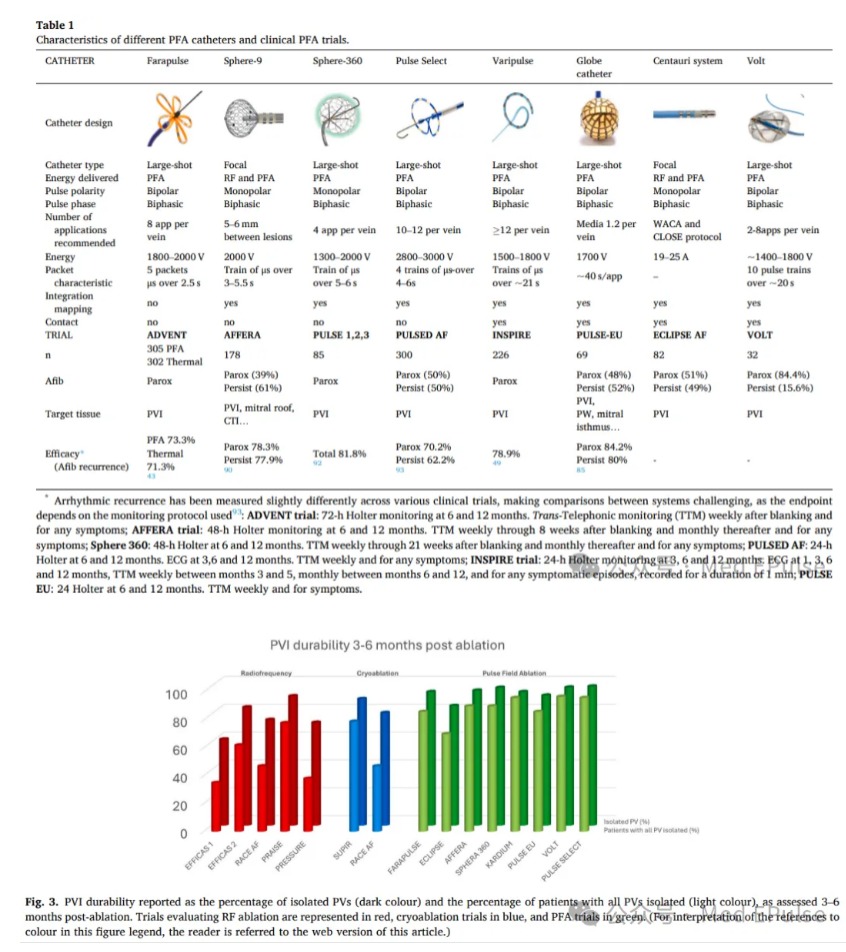
PVI成功率:临床试验显示急性隔离率73–85%,与RF相当(ADVENT trial: PFA73.3% vs. 热消融71.3%)。
-
复发率:阵发性房颤年复发率25–30%,持续性房颤30–40%,与传统技术无显著差异,但手术时间缩短40%(94min vs. RF 157min)。
图片来源:Med EPluse
病变持久性的决定因素
-
组织学特征:PFA形成边界清晰的纤维化病灶,炎症反应轻于RF,损伤更均匀。
-
透壁性优化:单极配置、增加脉冲次数可提升深度,但存在“饱和效应”。单极配置损伤深度可达6.5mm,双极配置实现相同深度则需更高能量;脉冲次数与深度呈饱和效应,超过一定次数后深度增加有限。迄今为止,大多数PFA系统的临床前研究表明,所达到的组织深度与热消融相似。
-
贴靠力争议:使用双极配置的一些研究表明,尽管组织贴靠对于达到深度至关重要,但增加贴靠力并不能有效加深病变。相反,分析单极配置中贴靠力影响的研究表明,随着接触力的增加(4至55g),病变深度显著增加,右心室(RV)为2.9至7.3mm,左心室(LV)为2.5至8.4mm。然而,似乎超过10-15g的力后,组织深度和宽度都达到平台期,增加并不明显。所以提示双极配置(现大部分导管为双极)中,贴靠力对深度影响有限,过度施压无效,反倒可能带来安全性风险。
-
损伤评估挑战:传统电信号消失(如电压<0.5mV)可能因细胞“电晕”高估疗效,但目前没有工具可以区分这种信号消失中有多少归因于不可逆损伤与细胞“电晕“/可逆损伤,或可结合HFDS-LAS(高频介电传感病变评估系统,前期探索中)介电传感或PS-OCR光学(用于评估脉冲场消融后组织损伤程度及病变耐久性的新型光学成像技术,前期探索中)评估损伤的不可逆性边界。
安全性管理:并发症与防控策略
与传统热消融的安全性对比
-
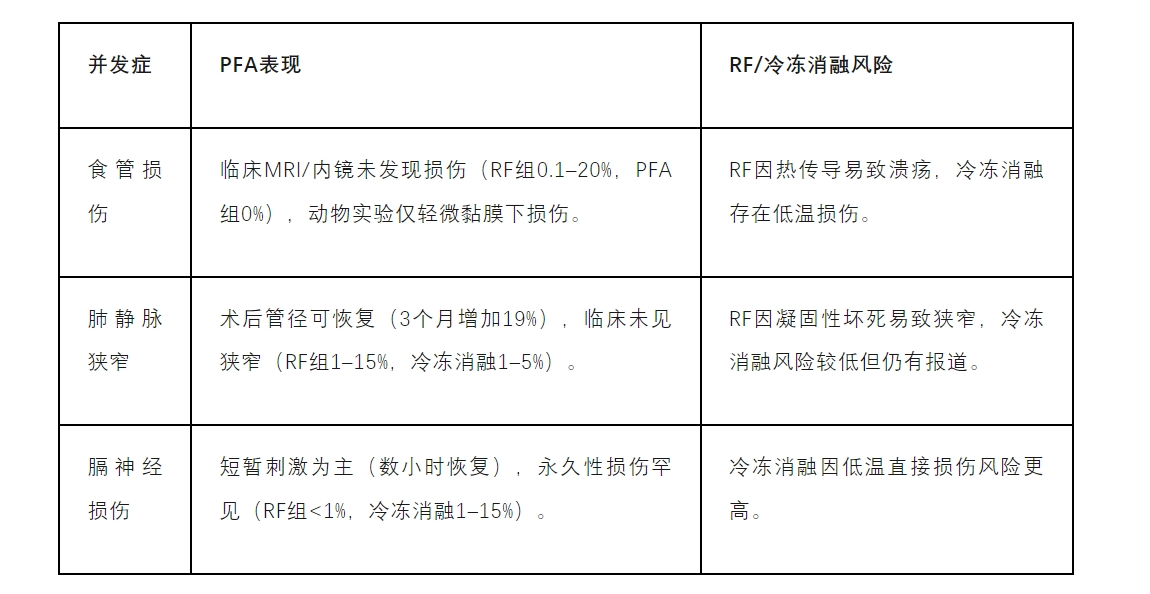
食管保护机制:食管损伤阈值高+周围脂肪组织衰减电场(30%场强衰减)+细胞外基质保留促修复(允许再生)。
-
无肺静脉狭窄:这可能是由于缺乏凝固性坏死有关。
PFA特异性并发症及防控
-
溶血与肾损伤:
机制:电场强度≥1000V/cm致红细胞损伤,导管设计与血流接触面积是主因,有报道溶血率可达94%(Farapulse导管,RF仅7%)。
防控:限制脉冲次数(<60次,Farapulse导管)、优化电极设计(球囊隔离血液)、贴靠再消融。术后2L补液减轻血红蛋白肾毒性,但无法消除亚临床损伤。
血红蛋白的释放不是肾毒性的唯一来源,脉冲场消融期间肌肉骨骼的刺激程度也会导致肌红蛋白释放,这对肾脏同样有毒性,而不同的脉冲场消融系统引起的肌肉骨骼刺激程度不同。
-
冠状动脉痉挛:
靠近冠脉(如CTI消融)时发生率高,机制可能主要与平滑肌细胞刺激相关,需保持>6.5mm安全距离或预用硝酸甘油(1–3mgIV),实时影像导航。
已有几种机制被提出来解释CTI/MI消融的冠脉痉挛。体外研究表明,在冠状动脉附近进行脉冲场消融后,会出现交感神经介导的雷诺样现象,而在治疗前给予肾上腺素能阻断剂利血平可显著减轻这种现象。其他临床前研究表明,脉冲场消融期间的血管痉挛机制可能涉及位于动脉壁中膜的平滑肌细胞的激活,因为在其他含有平滑肌的器官如食管中也观察到了平滑肌收缩。但这一现象的确切原因仍然未知。
-
微气泡栓塞:
脉冲场消融期间的微泡形成可能由水解或血液中氮气的置换或热反应引起。单相配置似乎通过电化学反应促进微泡的产生,而双相脉冲产生的微泡可能与局部过热有关,通过沸腾过程形成,尤其是在电极边缘周围(所谓的“边缘效应加热”)。
单相脉冲易产生大气泡(>38μm),双相短脉冲+长间隔可减少风险,临床无症状脑栓塞率5–20%(与RF相似)。
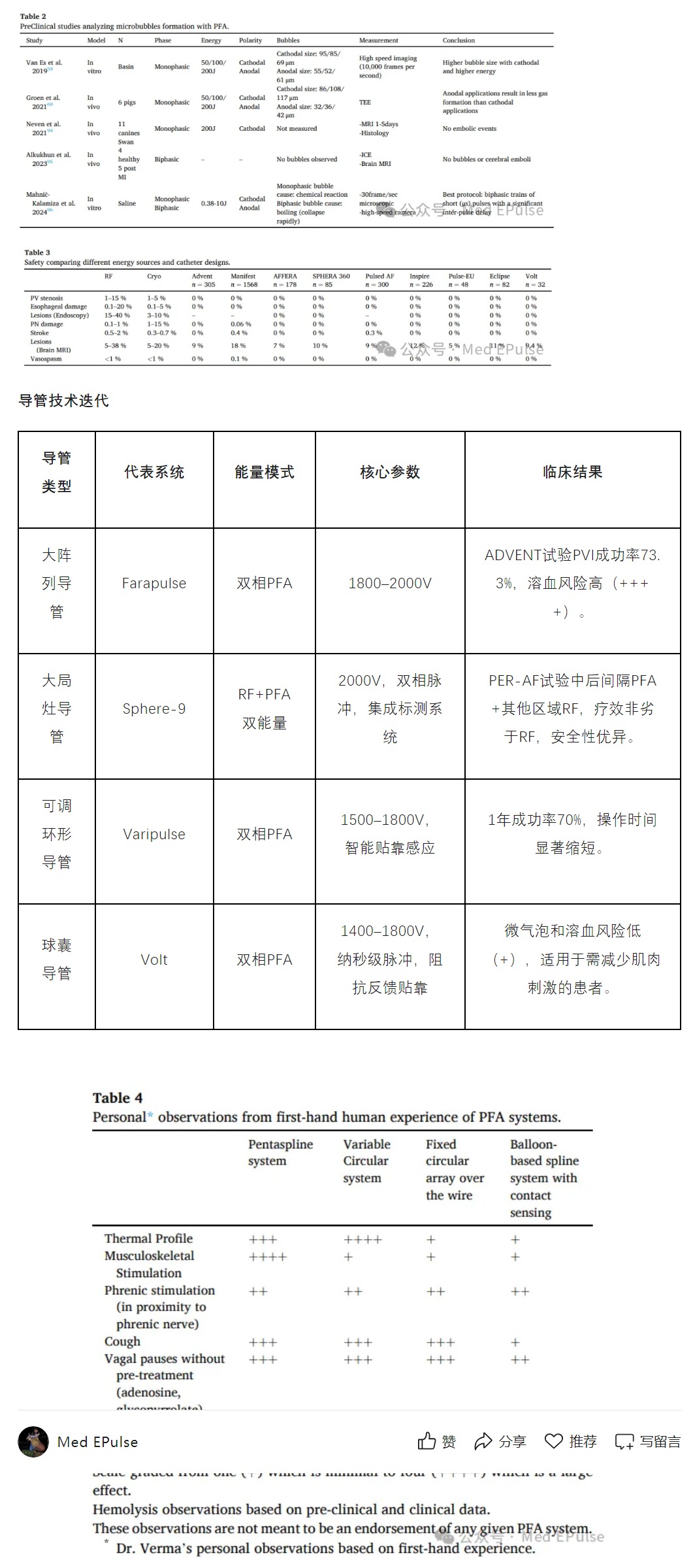
图片来源:Med EPluse
未来技术方向与临床研究
技术革新
-
纳秒脉冲系统:电压>2000V,减少骨骼肌刺激,探索对瘢痕组织的穿透性,或是心室消融的一个选择(如VCAS试验达11mm)。
-
智能化导管:集成电生理标测、贴靠感应(如Globe catheter血流图反馈)与混合能量消融模式(PFA+RF),实现精准消融。
临床研究拓展
-
适应症扩展:从房颤向室速、肥厚型心肌病延伸,待VENTURE试验评估纳秒PFA对室速的疗效。
-
联合治疗:PFA与RF/冷冻联合序贯应用,增强透壁性(如COMBO研究损伤体积增加40%)。
行业挑战
-
标准化缺失:脉冲参数(如双相脉冲间隔)缺乏统一标准,需建立跨产品评估体系。
-
临床技能要求:电生理医师需掌握HFDS-LAS(损伤范围识别)等新型评估工具及冠脉痉挛处理。
临床实践建议
适应症优先:
-
优选PFA:高食管风险(如左房后壁)、肺静脉狭窄等高危患者。
-
谨慎选择:严重肾功能不全(溶血风险)、冠脉邻近区域(如CTI)需联合硝酸甘油。
操作要点:
-
邻近食管区域:使用双极+低电压(1500V)导管,避免长时间脉冲消融;
-
冠脉附近:保持>6.5mm距离,预注射硝酸甘油,实时X线监测。
并发症监测:
-
术后48h监测血肌酐、游离血红蛋白(>500mg/dL提示溶血);
-
脑MRI随访:无症状栓塞率5–20%,与RF相似但需关注持续性病灶。
PFA以非热消融机制,在房颤管理中展现与传统技术相当的疗效和更优的安全性,尤其在食管/肺静脉保护方面优势显著。尽管溶血、冠脉痉挛等风险需警惕,但其整体并发症率低于RF和冷冻消融。未来纳秒脉冲、智能导管等技术迭代将推动PFA向心室消融等复杂场景拓展。
文章来源:Med EPluse
文章内容仅供知识交流分享使用,如涉侵权请联系我们删除。
