ISO官网能看到ISO 10993-1:2025版已经处于即将发布状态,并且预计发布时间是今年9月。和上海医疗器械展一起来看看更新了哪些吧。

图片来源:医械合规金渐层
-
进行全面结构调整,与ISO 14971风险管理框架保持一致; -
新增内容以提供更详细的暴露持续时间计算指南和说明; -
增补设备特性描述和生物危害识别的详细指导; -
对生物学效应Biological effects(原”生物学终点Biologocal endpoints”)的识别方法进行了修改; -
“外部接入externally communication”被反映器械组件特定组织接触取代; -
“植入后效应”改为”组织接触后局部效应”; -
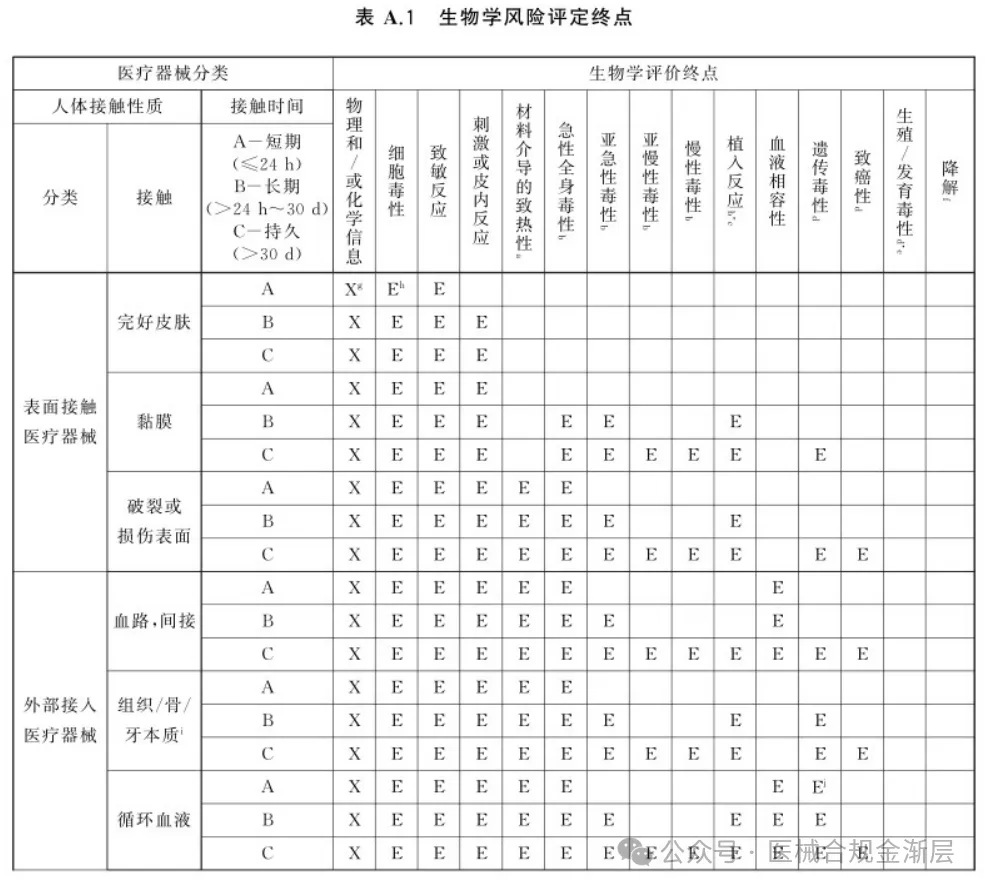
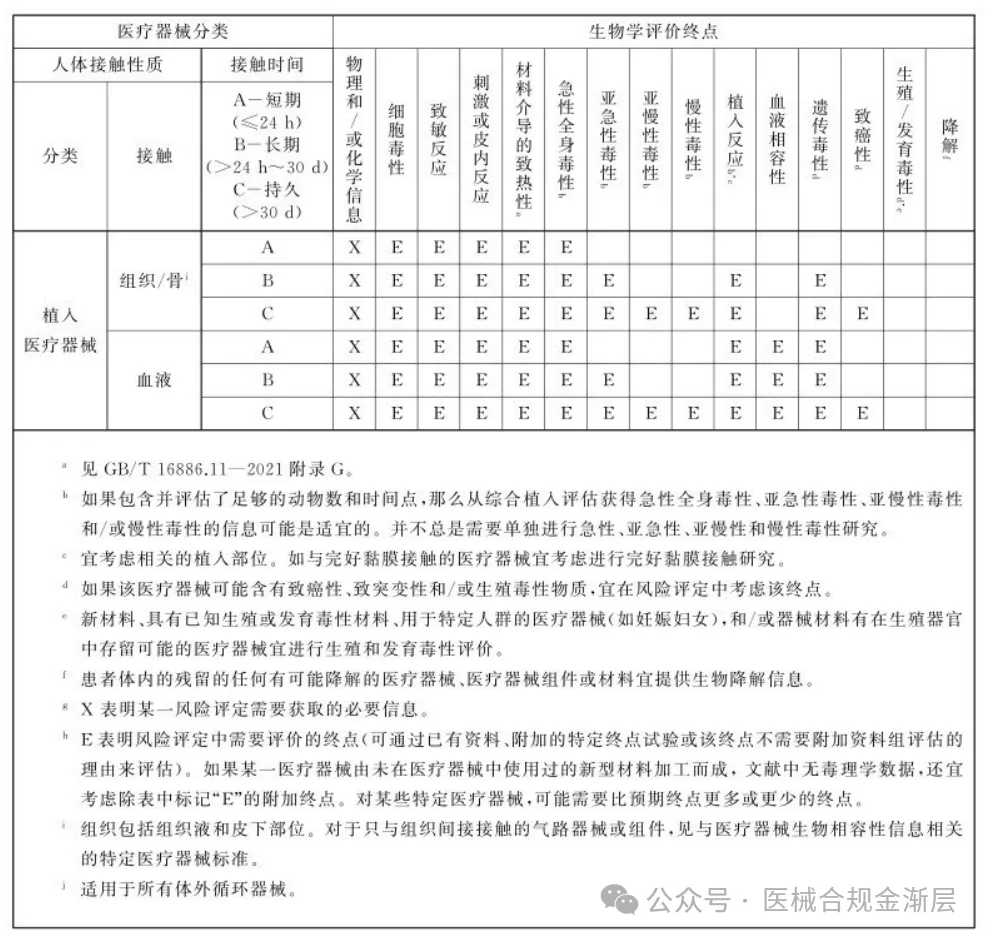
修订附录A.1,拆分成了4张新表,按照新拆分的4种接触类型归类需要考虑的生物效应; -
新增附录B解释表1至表4中生物学效应变更的理论依据。

图片来源:医械合规金渐层
图片来源:医械合规金渐层
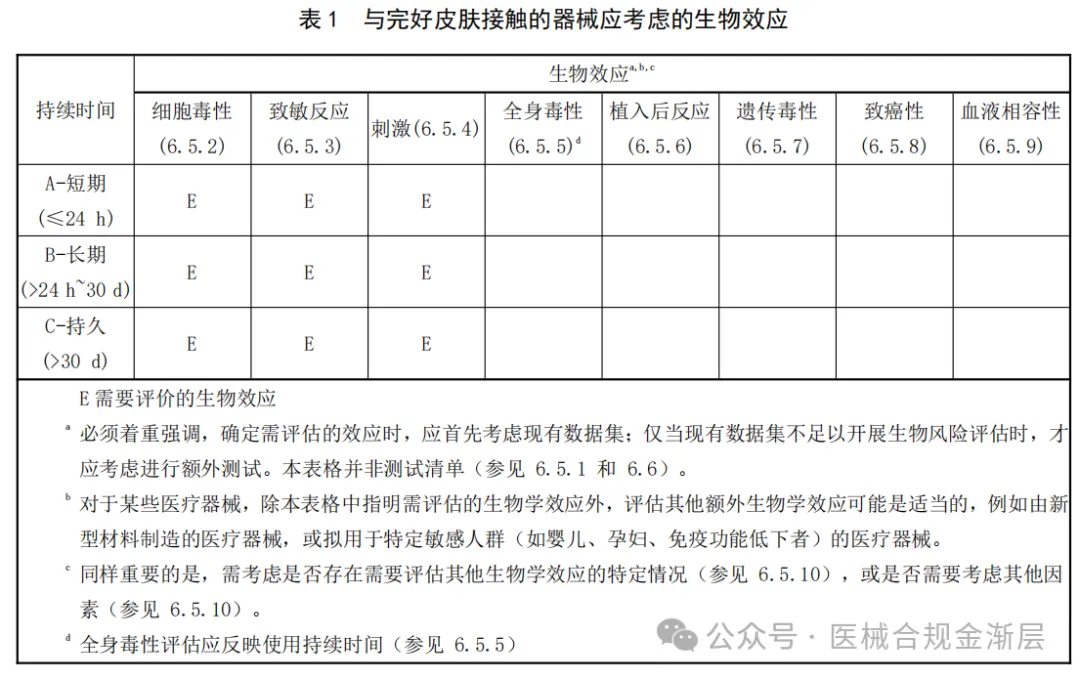
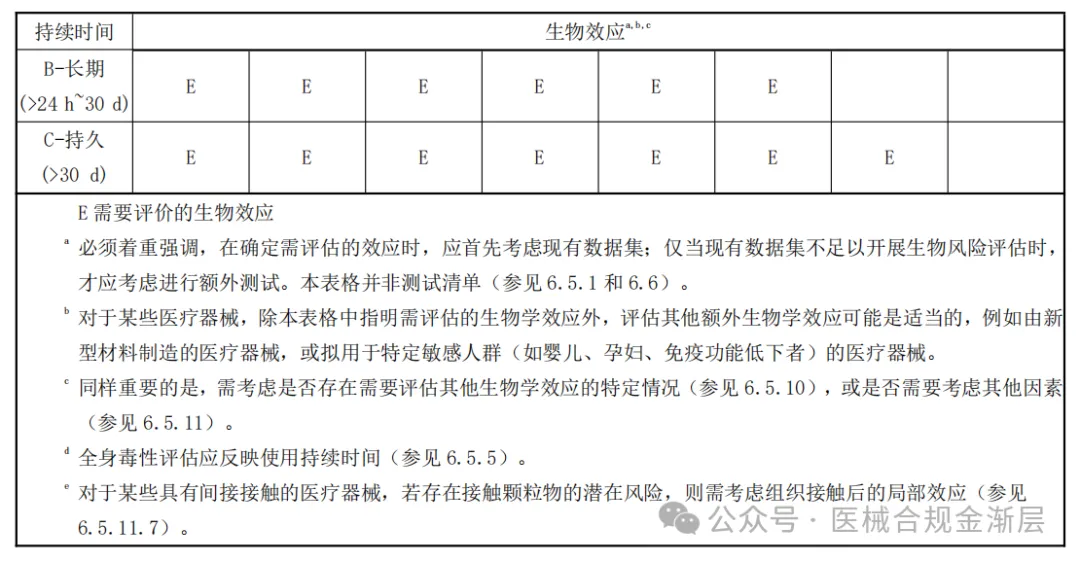
2025版的生物终点是4张小表,对应上表2025版的接触类型,如下:
图片来源:医械合规金渐层
其中,
粘膜接触B类增加了遗传毒性;
粘膜接触C类增加了致癌性;
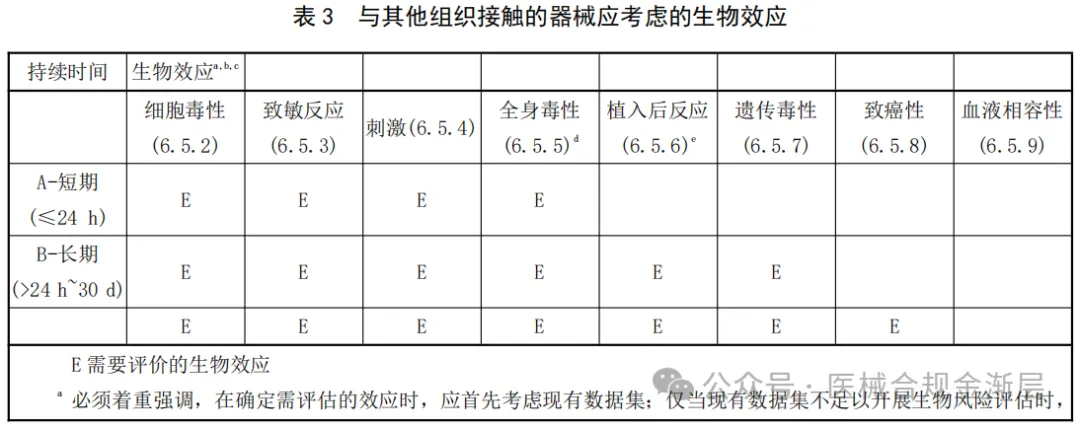
图片来源:医械合规金渐层
其中,破损表面B类增加了遗传毒性;
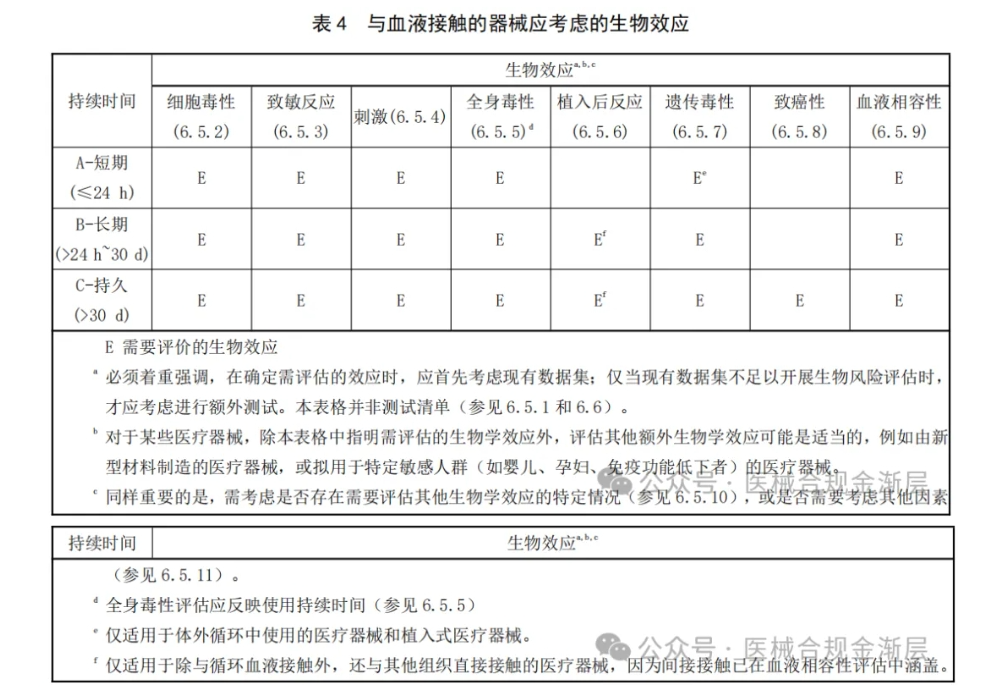
图片来源:医械合规金渐层
-
选择医疗器械材料时,首要考虑其特性与性能是否满足用途要求;
-
制造商需评估器械在运输、储存或使用中可能发生的特性变化;
-
对于可重复使用器械,生物安全性评价应基于预期使用寿命的循环周期。
-
上市后,将新发现或变化的生物风险纳入整体风险管理流程,及时审查和更新生物评估;
这一点对于文件的要求则是需要从生命周期的全局考量风险,主要表现在:
-
需要分析原材料的性质、可能带来的生物学风险;
-
加工过程可能引入的新生物学风险,比如加工剂、加工残留等;
-
考虑运输、储存或者使用过程中的风险,比如如果包装材料不稳定,考虑运输后做生物学测试;
-
上市后数据的及时获取与更新;
-
将使用的动物数量减少到最低;
-
改进实验方式,尽量减少痛苦;
-
引入风险管理,增加评估人员资质要求; -
接触类型变更成5个大类,并且生物效应评估表格随之拆分; -
部分类型增加遗传毒与致癌要求; -
生物学评估覆盖全生命周期;
文章来源:医械合规金渐层
文章内容仅供知识交流分享使用,如涉侵权请联系我们删除。
