对于计划进军美国市场的医疗器械企业,FDA 注册是绕不开的关卡。其中,510K 豁免作为低风险器械的 “快捷通道”,能大幅简化上市流程。上海医疗器械展览会将通过表格与文字结合的方式,清晰梳理 510K 豁免的核心信息。
FDA510(k) 豁免 ≠ 免FDA注册!
一、510K 豁免的核心概念
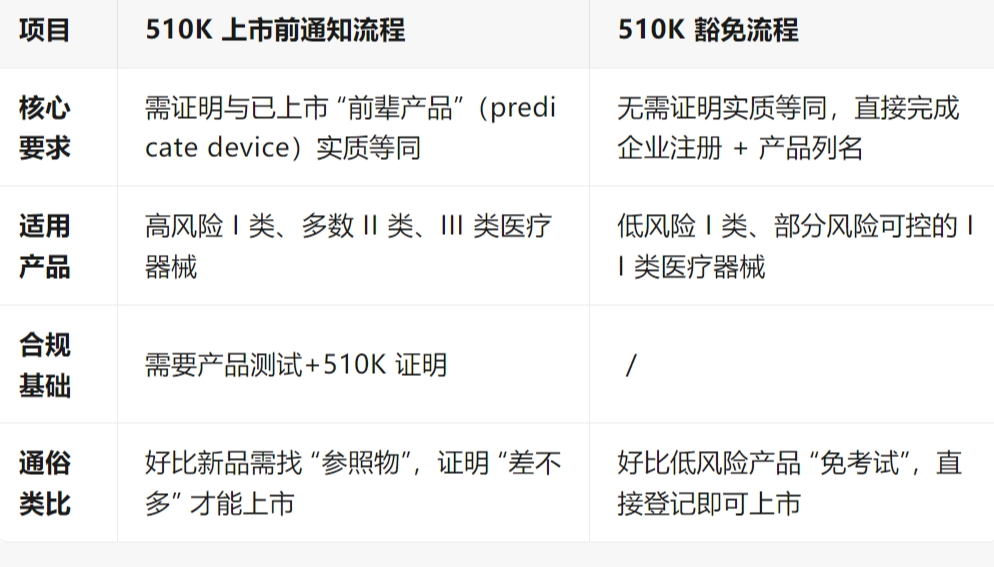

二、510K 豁免产品的具体范围
510K 豁免产品主要集中在低风险品类,以下为常见示例(完整清单需查询 FDA 官网分类数据库,结合 3 位字母代码确认):

三、510K 豁免产品的注册流程(分步详解)
步骤 1:确认产品分类及合规要求
-
核心动作:通过 FDA 官网或第三方机构查询,确认产品是否在豁免清单内。 -
关键判断: -
若 “510K 豁免且 GMP 豁免”:仅需完成企业注册 + 产品列名; -
若 “510K 豁免但 GMP 不豁免”:需额外满足 QSR820 质量体系要求(注意:2025 年 5 月起 FDA 验厂取消提前通知,建议提前建立体系)。
-
步骤 2:准备基础材料
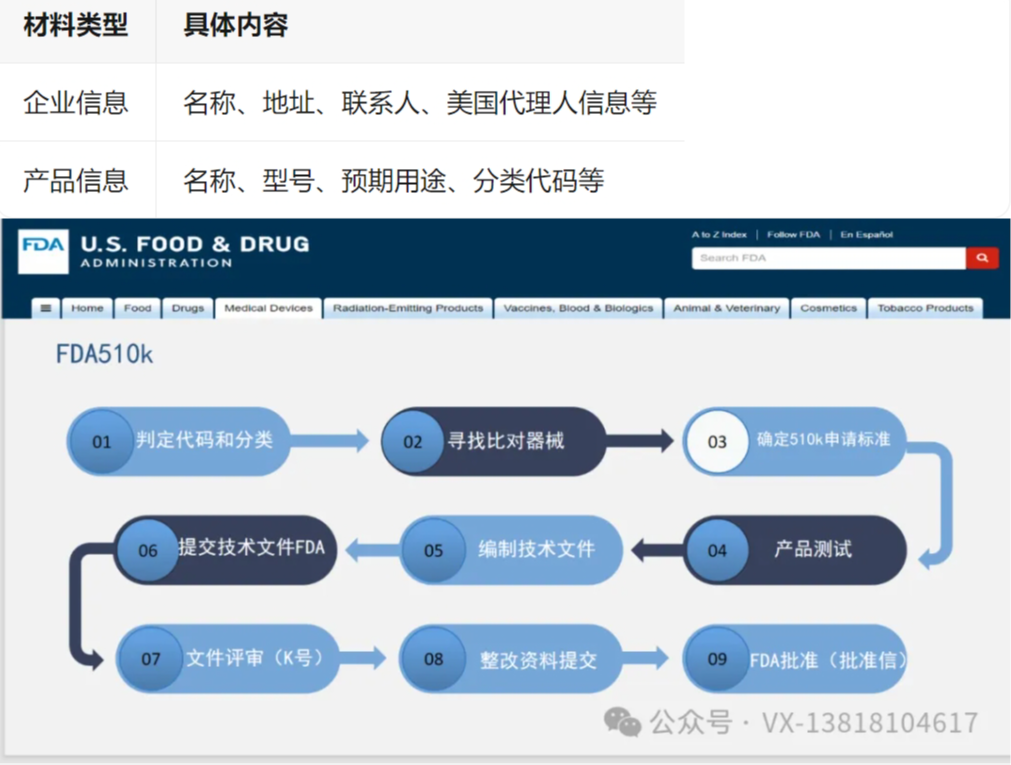
步骤 3:申请 PIN 码并支付年费
-
流程:向 FDA 申请 “付款识别码(PIN)”→ 缴纳年费(2026 年为 11423 美元,是企业费用,与产品数量多少无关)→ 获取 “受款验证码(PCN)”(缴费凭证)。
步骤 4:提交注册与产品列名
-
企业注册:填写 FDA 申请表,提交企业及美国代理人信息; -
产品列名:提交产品详细信息(型号、规格等); -
确认环节:美国代理人需验证信息并回复 FDA。
步骤 5:获取注册文件
注册成功后将收到 3 个关键号码:
- Owner/Operator Number
(产权人识别号):企业身份标识; - Listing Number
(产品列名号):产品登记标识; - FEI Number
(设施登记号):90 天左右由 FDA 分配,前期清关可用前两个号码。
(查询注册状态:FDA 官网链接)
步骤 6:后续维护
|
|
|
|---|---|
|
|
|
|
|
|

四、关键细节与注意事项

总结
510K 豁免为低风险医疗器械打开了美国市场的 “快捷通道”,但 “企业注册 + 产品列名 + 合规维护” 的每一步都需严谨对待。如果您对具体产品分类或流程有疑问,欢迎留言咨询,专业团队将为您提供一对一解答。
SUNGO 可提供的核心服务清单
-
食品、医疗、化妆品等 FDA 注册 -
医疗器械 FDA 510K 申请 -
FDA 510K 认可的检测报告(自有实验室具备 CNAS、CMA、IAS 资质,获 FDA 认可) -
验厂配套服务:为被 FDA 抽查验厂的企业提供食品、医疗、药品、化妆品的 FDA 验厂前辅导、陪审和翻译;为未被抽查的企业提供 FDA 模拟审核、整改及体系建立辅导(适应 2025 年 5 月起验厂无提前通知的新规) -
FDA 验厂 483 不符合项目整改 -
FDA 警告信和黑名单移除
文章来源:SUNGO小袁
文章内容仅供知识交流分享使用,如涉侵权请联系我们删除。
