法规质量
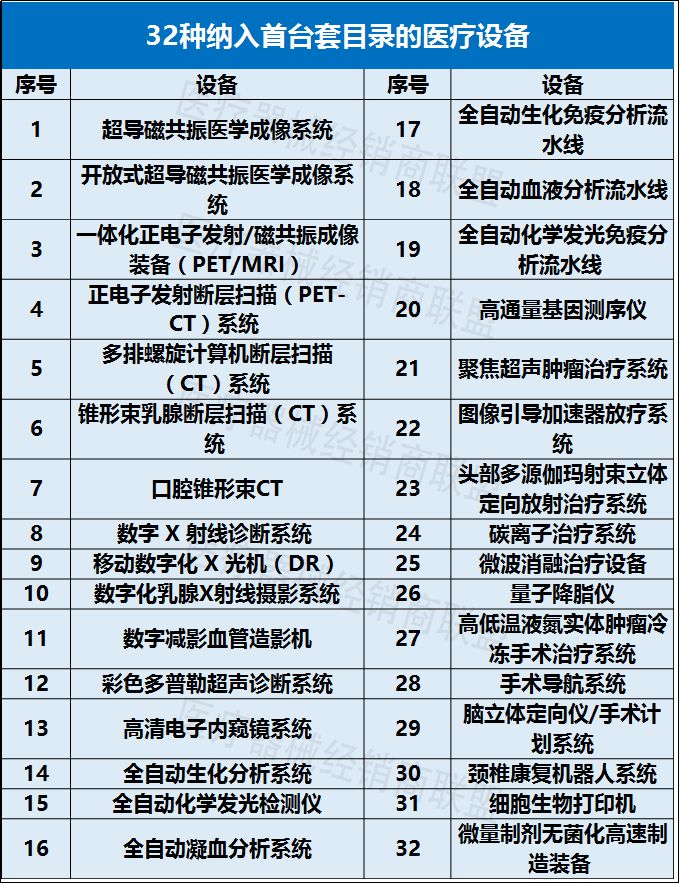
新政将出台!全面推进国产医疗设备进医院!!
7月13日下午,东莞市卫生计生局局长叶向阳率队到松山湖社卫中心、东莞市医疗器械行业协会进行调研。叶向阳明确,东莞将出台引导政策,全面倡导医疗行业优先使用国产设备
2018年7月24日
GB/T 19973.1-2015 标准解读
各个组织机构对警戒限和纠偏限的理解有所差异,该文对此进行分析比较,结合作者的理解给出了警戒限和纠偏限的定义;对合理确定警戒限和纠偏限的实施要点以及超出警戒限和纠偏限的调查进行总结概括;最后针对生物负载测定与医疗保健产品灭菌标准关系进行阐述。通过该文介绍,使读者更深刻理解GB/T19973.1-2015 的意义。
阅读更多
2018年7月16日
医疗器械注册人制度改革再加速 上海全市推广
医疗器械注册人制度改革再加速,推进得比预期中要快多了。而拜这一改革所赐,行业现有的所谓国产、进口医疗器械竞争格局也要被改变,大量进口医疗器械或将直接国产化,并更快获批上市,和减少生产成本,从而得以降价销售。
阅读更多
2018年7月10日
2018年7月6日
2018年7月4日
FDA医疗器械注册,分五步走!
医疗器械在美国上市前的第一个步骤就是依据联邦法规对器械进行分类。联邦食品、药品以及化妆品法案(FD&C Act)201(h)部分对医疗器械进行了定义,在联邦法规中可以看到对器械的分类,
2018年7月2日