法规质量
医疗器械企业自己开展试验还是外包给CRO?
国内部分企业自己开展临床试验,由于企业有多年的临床试验经验,公司持续有新产品,公司有临床试验团队。但很多大公司机制繁冗,虽然有项目,但并不多。基本是一个经理,带几个员工全都承包了,并没有医学、临床、培训、监督等分工,没有明确的推动机制。
2018年4月28日
医疗器械临床试验答疑
2018年3月29日,中国器审中心举办了医疗器械临床试验指导原则公益培训班,临床试验管理项目工作组就如何从清单的角度评价医疗器械的安全有效性、医疗器械临床评价基本要求、接受医疗器械境外临床试验数据技术指导原则以及医疗器械临床试验设计指导原则等行业关注度较高的内容进行了专题授课。
2018年4月28日
2018年4月27日
政策法规变动对医疗器械产业的影响
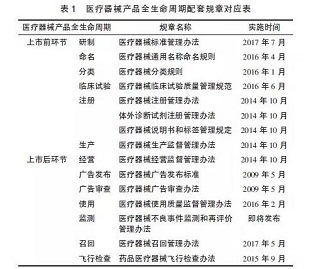
当前,以新版《条例》为核心,以部门规章为主体,以规范性文件为补充,我国已经构建了覆盖医疗器械监管全过程的医疗器械法规体系。这场大规模的法规巨变和制度更新带给医疗器械行业什么影响?相关企业应该何去何从?本文试就这一问题进行探讨。
2018年4月26日
创新医疗器械特别审批项目审查务实与展望
2014年2月7日,国家食品药品监督管理总局(以下简称“国家总局”)发布了《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号),自2014年3月1日起施行。该程序是在确保上市产品安全、有效的前提下,针对创新医疗器械设置的审批通道。
2018年4月26日
医疗器械临床试验方案病例数计算
对于一个试验究竟需要开展多少例?不是盲从以往项目的经验,也不是随随便便就开展,还是从科学的角度,进行设计和计算。具体还是要重视统计专家。一、CFDA对于医疗器械病例数的要求(不含IVD)1.1《医疗器械临床试验 …

2018年4月18日